Ley de los gases: descubre los principios fundamentales
La Ley de los Gases es un conjunto de principios fundamentales que describen el comportamiento de los gases en diferentes condiciones. Estos principios son esenciales para comprender varios fenómenos físicos y químicos, como la difusión, la presión y la temperatura de los gases. En este artículo, exploraremos los principios fundamentales de la Ley de los Gases y cómo se aplican en el mundo real.
- Principios fundamentales de la Ley de los Gases
- Aplicaciones de la Ley de los Gases
- Conclusión
-
Preguntas frecuentes
- ¿Qué es la Ley de los Gases?
- ¿Cuáles son los principios fundamentales de la Ley de los Gases?
- ¿Cómo se aplican los principios de la Ley de los Gases en la vida cotidiana?
- ¿Por qué es importante comprender la Ley de los Gases?
- ¿Cómo se pueden representar matemáticamente los principios de la Ley de los Gases?
Principios fundamentales de la Ley de los Gases
Existen cuatro principios fundamentales de la Ley de los Gases: la ley de Boyle, la ley de Charles, la ley de Gay-Lussac y la ley de Avogadro.
Ley de Boyle
La ley de Boyle establece que, a temperatura constante, la presión de un gas es inversamente proporcional al volumen que ocupa. Esto significa que, si se aumenta la presión del gas, el volumen disminuirá, y si se disminuye la presión, el volumen aumentará. Esta ley se puede representar matemáticamente como P1V1 = P2V2, donde P1 es la presión inicial, V1 es el volumen inicial, P2 es la presión final y V2 es el volumen final.
Un ejemplo práctico de la ley de Boyle son las jeringas utilizadas para inyectar medicamentos. Si se aplica presión en la jeringa, el volumen de aire disminuirá y el medicamento será expulsado.
Ley de Charles
La ley de Charles establece que, a presión constante, el volumen de un gas es directamente proporcional a la temperatura absoluta. Esto significa que, si se aumenta la temperatura del gas, el volumen aumentará, y si se disminuye la temperatura, el volumen disminuirá. Esta ley se puede representar matemáticamente como V1/T1 = V2/T2, donde V1 es el volumen inicial, T1 es la temperatura inicial, V2 es el volumen final y T2 es la temperatura final.
Un ejemplo práctico de la ley de Charles es el inflado de un globo. Si se calienta el aire dentro del globo, el volumen del gas aumentará y el globo se inflará.
Ley de Gay-Lussac
La ley de Gay-Lussac establece que, a volumen constante, la presión de un gas es directamente proporcional a la temperatura absoluta. Esto significa que, si se aumenta la temperatura del gas, la presión aumentará, y si se disminuye la temperatura, la presión disminuirá. Esta ley se puede representar matemáticamente como P1/T1 = P2/T2, donde P1 es la presión inicial, T1 es la temperatura inicial, P2 es la presión final y T2 es la temperatura final.
Un ejemplo práctico de la ley de Gay-Lussac es el funcionamiento de un motor de combustión interna. Cuando se enciende la mezcla de gas y aire en el motor, la temperatura aumenta y la presión también, lo que impulsa el movimiento del pistón.
Ley de Avogadro
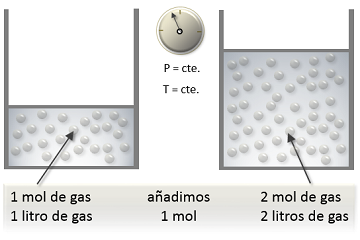
La ley de Avogadro establece que, a temperatura y presión constantes, el volumen de un gas es directamente proporcional a la cantidad de moles del gas. Esto significa que, si se aumenta la cantidad de moles del gas, el volumen aumentará, y si se disminuye la cantidad de moles, el volumen disminuirá. Esta ley se puede representar matemáticamente como V1/n1 = V2/n2, donde V1 es el volumen inicial, n1 es la cantidad de moles inicial, V2 es el volumen final y n2 es la cantidad de moles final.
Un ejemplo práctico de la ley de Avogadro es el inflado de un neumático. Si se agrega más gas al neumático, la cantidad de moles aumentará y el volumen del gas dentro del neumático también aumentará.
Aplicaciones de la Ley de los Gases
La Ley de los Gases tiene numerosas aplicaciones en la vida cotidiana y en la ciencia. Algunas de las aplicaciones más comunes incluyen:
- La refrigeración y el aire acondicionado, donde se utilizan gases para enfriar y calentar el aire.
- La industria química, donde se utilizan gases para producir diferentes productos químicos.
- La medicina, donde se utilizan gases como el oxígeno y el dióxido de carbono para tratar afecciones médicas.
- La ingeniería aeroespacial, donde se utilizan gases para propulsar cohetes y aviones.
Conclusión
La Ley de los Gases es un conjunto de principios fundamentales que describe el comportamiento de los gases en diferentes condiciones. Estos principios son esenciales para comprender varios fenómenos físicos y químicos, y tienen numerosas aplicaciones en la vida cotidiana y en la ciencia. Ya sea en la refrigeración, la medicina o la ingeniería aeroespacial, la Ley de los Gases es una herramienta esencial para comprender el mundo que nos rodea.
Preguntas frecuentes
¿Qué es la Ley de los Gases?
La Ley de los Gases es un conjunto de principios fundamentales que describen el comportamiento de los gases en diferentes condiciones.
¿Cuáles son los principios fundamentales de la Ley de los Gases?
Existen cuatro principios fundamentales de la Ley de los Gases: la ley de Boyle, la ley de Charles, la ley de Gay-Lussac y la ley de Avogadro.
¿Cómo se aplican los principios de la Ley de los Gases en la vida cotidiana?
La Ley de los Gases tiene numerosas aplicaciones en la vida cotidiana, incluyendo la refrigeración y el aire acondicionado, la industria química, la medicina y la ingeniería aeroespacial.
¿Por qué es importante comprender la Ley de los Gases?
La Ley de los Gases es esencial para comprender varios fenómenos físicos y químicos, y tiene numerosas aplicaciones en la vida cotidiana y en la ciencia.
¿Cómo se pueden representar matemáticamente los principios de la Ley de los Gases?
Cada principio de la Ley de los Gases se puede representar matemáticamente mediante una fórmula específica. Por ejemplo, la ley de Boyle se puede representar como P1V1 = P2V2, donde P1 es la presión inicial, V1 es el volumen inicial, P2 es la presión final y V2 es el volumen final.
Deja una respuesta