La Teoría Cinética: Descubre Cómo se Comportan los Gases
¿Alguna vez te has preguntado cómo se comportan los gases? ¿Por qué algunos gases son más densos que otros? ¿Por qué los gases se expanden cuando se calientan? La teoría cinética es la respuesta a estas preguntas y muchas más.
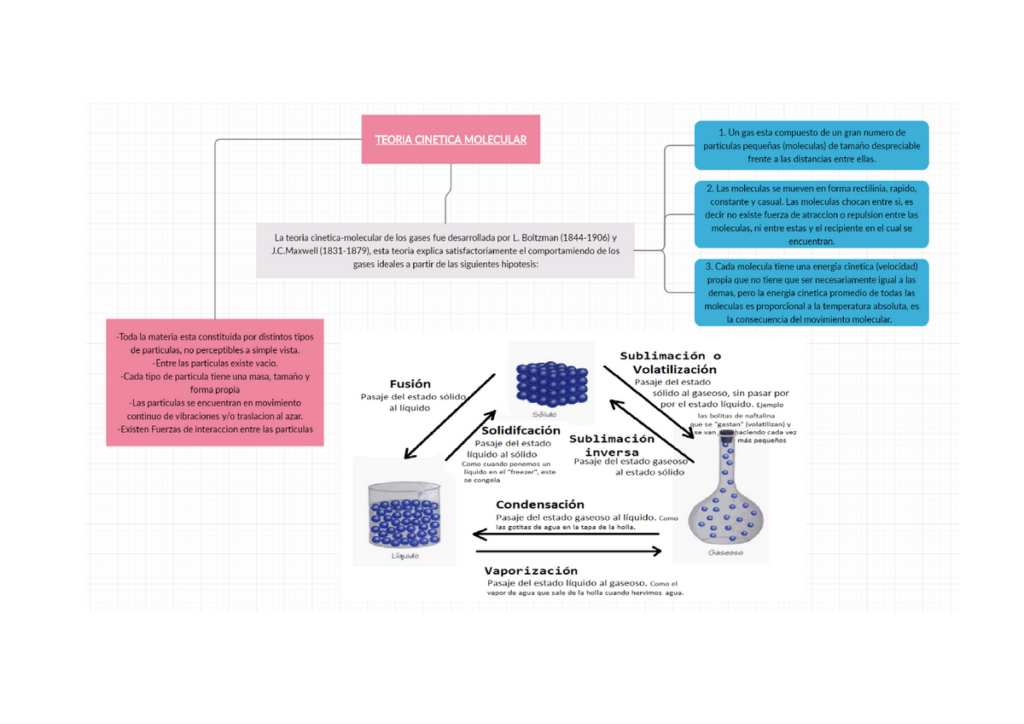
La teoría cinética es una rama de la física que estudia el comportamiento de los gases en términos de las partículas que los componen. Esta teoría se basa en la idea de que los gases están formados por moléculas que se mueven en todas direcciones a altas velocidades. Estas moléculas no están en reposo, sino que están en constante movimiento, chocando unas con otras y con las paredes del contenedor en el que se encuentran.
Las características de las partículas de los gases
Según la teoría cinética, las partículas de los gases tienen las siguientes características:
- Tamaño: las partículas de los gases son muy pequeñas en comparación con el tamaño del contenedor en el que se encuentran.
- Velocidad: las partículas de los gases se mueven a altas velocidades.
- Dirección: las partículas de los gases se mueven en todas las direcciones.
- Cantidad: el número de partículas de los gases es muy grande.
- Energía: las partículas de los gases tienen energía cinética debido a su movimiento.
La ley de Boyle
La ley de Boyle establece que la presión de un gas es inversamente proporcional al volumen que ocupa. Es decir, si la presión aumenta, el volumen disminuye y viceversa. Esto se debe a que las partículas de los gases están muy cerca unas de otras y, por lo tanto, cuando se reduce el volumen, las partículas chocan con las paredes del contenedor con mayor frecuencia, lo que aumenta la presión.
La ley de Charles
La ley de Charles establece que la temperatura de un gas es directamente proporcional a su volumen. Es decir, si la temperatura aumenta, el volumen también lo hace y viceversa. Esto se debe a que cuando se aumenta la temperatura, las partículas de los gases se mueven más rápido y, por lo tanto, necesitan más espacio para moverse.
La ley de Gay-Lussac
La ley de Gay-Lussac establece que la presión de un gas es directamente proporcional a su temperatura. Es decir, si la temperatura aumenta, la presión también lo hace y viceversa. Esto se debe a que cuando se aumenta la temperatura, las partículas de los gases se mueven más rápido y chocan con las paredes del contenedor con mayor frecuencia, lo que aumenta la presión.
La ley de Avogadro
La ley de Avogadro establece que el volumen de un gas es directamente proporcional al número de partículas que lo componen. Es decir, si se duplica el número de partículas, el volumen también se duplica y viceversa. Esto se debe a que cuando se agregan más partículas al gas, estas necesitan más espacio para moverse.
La difusión y la efusión de los gases
La difusión es el proceso por el cual los gases se mezclan debido al movimiento aleatorio de sus partículas. Es decir, las partículas de un gas se mueven hacia áreas de menor concentración de ese gas hasta que se alcanza un equilibrio. La efusión, por otro lado, es el proceso por el cual los gases se escapan a través de un pequeño agujero en un contenedor debido a la presión de las partículas.
La ley de Graham
La ley de Graham establece que la tasa de difusión de un gas es inversamente proporcional a la raíz cuadrada de su densidad. Es decir, los gases más densos difunden más lentamente que los gases menos densos.
La teoría cinética y las leyes de los gases ideales
Las leyes de los gases ideales son un conjunto de leyes que describen el comportamiento de los gases ideales en términos de su presión, volumen, temperatura y número de partículas. Estas leyes se basan en la teoría cinética y son muy útiles para resolver problemas relacionados con los gases.
Conclusión
La teoría cinética es una herramienta fundamental para entender el comportamiento de los gases. Nos permite comprender por qué los gases se expanden cuando se calientan, cómo se pueden mezclar diferentes gases y mucho más. Al entender las leyes de los gases ideales y las características de las partículas de los gases, podemos resolver problemas relacionados con los gases en la vida diaria y en la ciencia.
Preguntas frecuentes
1. ¿Por qué los gases se expanden cuando se calientan?
Los gases se expanden cuando se calientan porque las partículas de los gases se mueven más rápido y necesitan más espacio para moverse. Cuando las partículas chocan con las paredes del contenedor, ejercen más presión, lo que hace que el gas se expanda.
2. ¿Por qué algunos gases son más densos que otros?
Los gases más densos tienen moléculas más pesadas que los gases menos densos. Estas moléculas se mueven más lentamente y necesitan menos espacio para moverse, lo que hace que el gas sea más denso.
3. ¿Por qué los gases se mezclan?
Los gases se mezclan debido al movimiento aleatorio de sus partículas. Las partículas de un gas se mueven hacia áreas de menor concentración de ese gas hasta que se alcanza un equilibrio.
4. ¿Qué es la difusión de los gases?
La difusión es el proceso por el cual los gases se mezclan debido al movimiento aleatorio de sus partículas. Es decir, las partículas de un gas se mueven hacia áreas de menor concentración de ese gas hasta que se alcanza un equilibrio.
5. ¿Cuáles son las leyes de los gases ideales?
Las leyes de los gases ideales son un conjunto de leyes que describen el comportamiento de los gases ideales en términos de su presión, volumen, temperatura y número de partículas. Estas leyes se basan en la teoría cinética y son muy útiles para resolver problemas relacionados con los gases.
Deja una respuesta