Domina la química: aprende a sacar el número cuántico
La química es una ciencia fascinante que nos permite comprender el comportamiento de la materia y las reacciones químicas. Una de las herramientas fundamentales de la química son los números cuánticos, que nos permiten describir la estructura de los átomos y las propiedades de los electrones en los niveles energéticos. En este artículo, te enseñaremos a sacar el número cuántico y a dominar la química.
¿Qué son los números cuánticos?
Los números cuánticos son valores que se utilizan para describir la energía y el movimiento de los electrones en los átomos. Existen cuatro números cuánticos diferentes: el número cuántico principal (n), el número cuántico secundario o de momento angular (l), el número cuántico magnético (m) y el número cuántico de espín (s).
El número cuántico principal (n) describe el nivel energético del electrón. Los valores de n son números enteros mayores o iguales a 1, y a medida que n aumenta, la energía del electrón y el tamaño del orbital aumentan.
El número cuántico secundario o de momento angular (l) describe la forma del orbital. Los valores de l dependen del valor de n, y pueden ser cualquier número entero entre 0 y n-1. Los valores de l también están relacionados con la letra que se utiliza para designar el tipo de orbital: s (l=0), p (l=1), d (l=2) y f (l=3).
El número cuántico magnético (m) describe la orientación del orbital en el espacio. Los valores de m dependen del valor de l, y pueden ser cualquier número entero entre -l y l.
El número cuántico de espín (s) describe la dirección del espín del electrón. Los valores de s pueden ser +1/2 o -1/2.
Cómo sacar el número cuántico
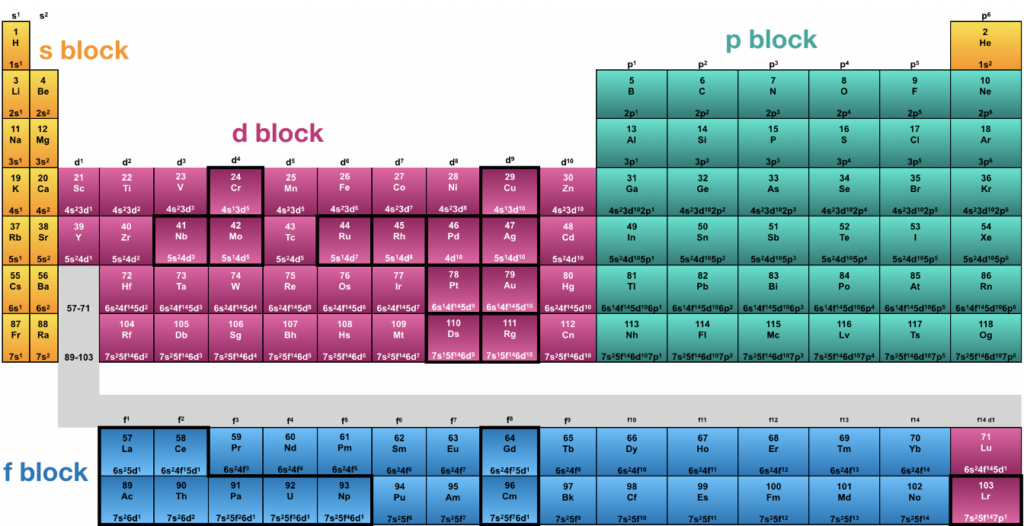
Para sacar el número cuántico de un electrón en un átomo, se deben conocer los valores de n, l y m. Estos valores pueden determinarse a partir de la configuración electrónica del átomo y de la tabla periódica.
Por ejemplo, si queremos sacar el número cuántico de un electrón en el orbital 2p del átomo de oxígeno (O), primero debemos saber que el número cuántico principal es 2 (porque está en el segundo nivel energético) y que el número cuántico secundario es 1 (porque es un orbital p). El número cuántico magnético puede ser -1, 0 o 1, dependiendo de la orientación del orbital en el espacio.
Por lo tanto, el número cuántico del electrón en el orbital 2p del átomo de oxígeno puede ser 2,1,-1; 2,1,0; o 2,1,1.
Por qué son importantes los números cuánticos
Los números cuánticos son importantes porque nos permiten entender la estructura de los átomos y las propiedades de los electrones en los niveles energéticos. Conociendo los números cuánticos de un electrón, podemos saber en qué nivel energético se encuentra, la forma de su orbital, su orientación en el espacio y la dirección de su espín. Estos datos son fundamentales para entender las reacciones químicas y las propiedades de los elementos.
Por ejemplo, los elementos de la tabla periódica tienen propiedades químicas similares debido a su configuración electrónica y a sus números cuánticos. Los elementos del grupo 1 tienen un electrón en la capa externa (n=1), mientras que los elementos del grupo 18 tienen ocho electrones en la capa externa (n=2 y l=0). Estas similitudes en los números cuánticos se traducen en similitudes en la reactividad y las propiedades físicas de los elementos.
Conclusión
Los números cuánticos son una herramienta fundamental para entender la estructura de los átomos y las propiedades de los electrones en los niveles energéticos. Aprender a sacar el número cuántico es esencial para dominar la química y comprender las reacciones químicas y las propiedades de los elementos. Esperamos que este artículo te haya sido útil para entender los números cuánticos y su importancia en la química.
Preguntas frecuentes
1. ¿Qué son los números cuánticos?
Los números cuánticos son valores que se utilizan para describir la energía y el movimiento de los electrones en los átomos.
2. ¿Cuáles son los cuatro números cuánticos?
Los cuatro números cuánticos son el número cuántico principal (n), el número cuántico secundario o de momento angular (l), el número cuántico magnético (m) y el número cuántico de espín (s).
3. ¿Cómo se saca el número cuántico de un electrón en un átomo?
El número cuántico de un electrón en un átomo se saca a partir de la configuración electrónica del átomo y de la tabla periódica, conociendo los valores de n, l y m.
4. ¿Por qué son importantes los números cuánticos?
Los números cuánticos son importantes porque nos permiten entender la estructura de los átomos y las propiedades de los electrones en los niveles energéticos, lo que es fundamental para entender las reacciones químicas y las propiedades de los elementos.
5. ¿Cómo se relacionan los números cuánticos con las propiedades de los elementos?
Los números cuánticos están relacionados con las propiedades de los elementos porque la configuración electrónica y los números cuánticos determinan la reactividad y las propiedades físicas de los elementos.
Deja una respuesta