Descubre los elementos monovalentes: Guía completa
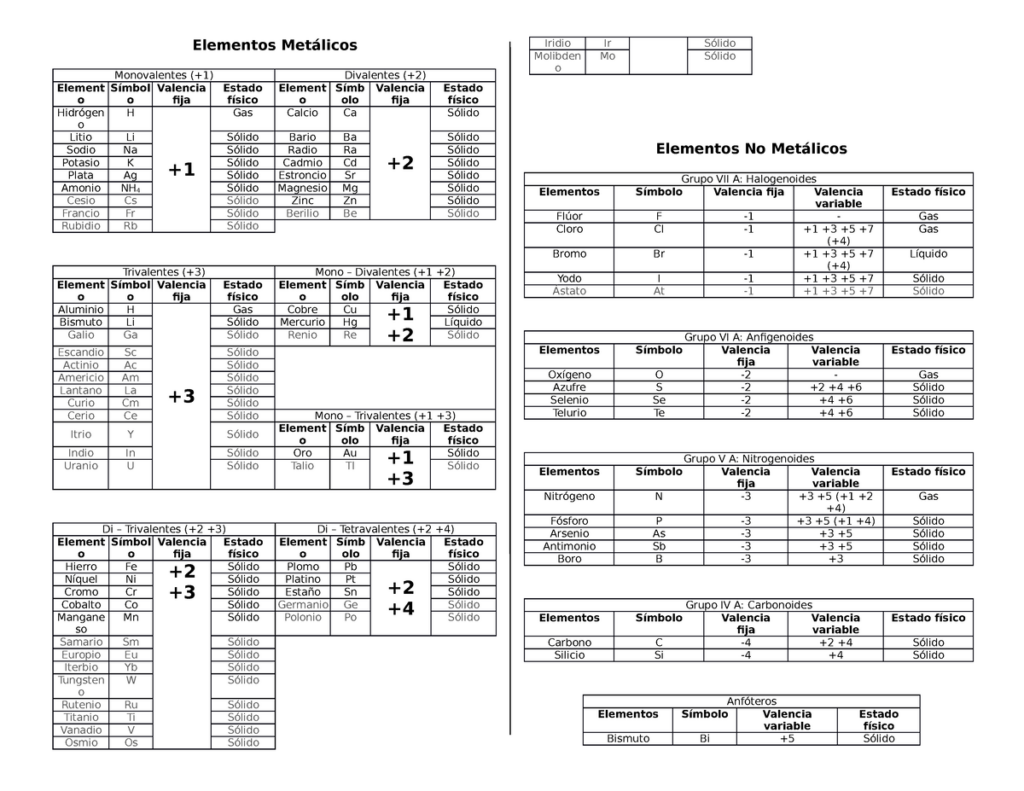
Cuando hablamos de elementos monovalentes, nos referimos a aquellos que tienen una valencia de uno. Esto significa que tienen la capacidad de formar un solo enlace químico con otro átomo. En este artículo, te vamos a presentar una guía completa sobre los elementos monovalentes, desde su definición hasta sus propiedades y aplicaciones en la vida cotidiana. ¡Comencemos!
- ¿Qué son los elementos monovalentes?
- ¿Cuáles son las propiedades de los elementos monovalentes?
- Aplicaciones de los elementos monovalentes
- Conclusiones
-
Preguntas frecuentes
- 1. ¿Por qué los elementos monovalentes tienen una valencia de uno?
- 2. ¿Por qué el sodio reacciona violentamente con el agua?
- 3. ¿Por qué el potasio es esencial para los seres vivos?
- 4. ¿Por qué el francio no tiene aplicaciones prácticas en la vida cotidiana?
- 5. ¿Cómo se utilizan los elementos monovalentes en la fabricación de células fotoeléctricas?
¿Qué son los elementos monovalentes?
Los elementos monovalentes son aquellos que tienen una valencia de uno. Esto significa que tienen la capacidad de formar un solo enlace químico con otro átomo. Los elementos monovalentes se encuentran en el grupo 1 de la tabla periódica, también conocido como el grupo de los metales alcalinos. Los elementos que pertenecen a este grupo son:
- Litio (Li)
- Sodio (Na)
- Potasio (K)
- Rubidio (Rb)
- Cesio (Cs)
- Francio (Fr)
¿Cuáles son las propiedades de los elementos monovalentes?
Los elementos monovalentes tienen algunas propiedades en común, como su baja energía de ionización, lo que significa que pierden fácilmente un electrón para formar un enlace químico con otro átomo. Además, tienen un bajo punto de fusión y ebullición y son muy reactivos.
Litio
El litio es un metal blando y plateado que se encuentra en la naturaleza en forma de compuestos. Es el elemento más ligero de todos los metales y tiene una baja densidad. El litio se utiliza en la fabricación de baterías recargables, aleaciones metálicas y vidrios especiales.
Sodio
El sodio es un metal plateado y blando que reacciona violentamente con el agua. Se encuentra en la naturaleza en forma de compuestos, como la sal de mesa. El sodio se utiliza en la fabricación de vidrio, productos químicos y en la industria alimentaria como conservante.
Potasio
El potasio es un metal blando y plateado que se encuentra en la naturaleza en forma de compuestos. Es un elemento esencial para los seres vivos, ya que participa en la regulación del equilibrio de agua y electrolitos en el organismo. El potasio también se utiliza en la fabricación de fertilizantes y en la industria química.
Rubidio
El rubidio es un metal blando y plateado que se encuentra en la naturaleza en forma de compuestos. Es un elemento muy raro y se utiliza en la fabricación de células fotoeléctricas y relojes atómicos.
Cesio
El cesio es un metal blando y plateado que se encuentra en la naturaleza en forma de compuestos. Es un elemento muy raro y se utiliza en la fabricación de células fotoeléctricas, relojes atómicos y en la medicina nuclear.
Francio
El francio es el elemento más raro y radiactivo de todos los metales alcalinos. Se encuentra en la naturaleza en forma de compuestos y tiene una vida media de solo 22 minutos. Debido a su corta vida media y su alta radiactividad, el francio no tiene aplicaciones prácticas en la vida cotidiana.
Aplicaciones de los elementos monovalentes
Los elementos monovalentes tienen una amplia variedad de aplicaciones en la vida cotidiana. Algunas de ellas son:
- La fabricación de baterías recargables, en el caso del litio.
- La regulación del equilibrio de agua y electrolitos en el organismo, en el caso del potasio.
- La fabricación de vidrio y productos químicos, en el caso del sodio y el potasio.
- La fabricación de células fotoeléctricas y relojes atómicos, en el caso del rubidio y el cesio.
Conclusiones
Los elementos monovalentes son aquellos que tienen una valencia de uno y pertenecen al grupo 1 de la tabla periódica. Estos elementos tienen propiedades en común, como su baja energía de ionización y su capacidad de formar un solo enlace químico con otro átomo. Los elementos monovalentes tienen aplicaciones prácticas en la vida cotidiana, como la fabricación de baterías recargables, la regulación del equilibrio de agua y electrolitos en el organismo y la fabricación de vidrio y productos químicos.
Preguntas frecuentes
1. ¿Por qué los elementos monovalentes tienen una valencia de uno?
Los elementos monovalentes tienen una valencia de uno porque tienen un solo electrón en su capa de valencia, lo que les permite formar un solo enlace químico con otro átomo.
2. ¿Por qué el sodio reacciona violentamente con el agua?
El sodio reacciona violentamente con el agua debido a su alta reactividad. Al entrar en contacto con el agua, el sodio pierde su electrón de valencia y forma hidróxido de sodio (NaOH) y gas hidrógeno (H2) como productos de la reacción.
3. ¿Por qué el potasio es esencial para los seres vivos?
El potasio es esencial para los seres vivos porque participa en la regulación del equilibrio de agua y electrolitos en el organismo. Además, el potasio es necesario para el correcto funcionamiento del sistema nervioso y muscular.
4. ¿Por qué el francio no tiene aplicaciones prácticas en la vida cotidiana?
El francio no tiene aplicaciones prácticas en la vida cotidiana debido a su corta vida media y su alta radiactividad. Esto hace que sea muy difícil de manejar y que represente un riesgo para la salud.
5. ¿Cómo se utilizan los elementos monovalentes en la fabricación de células fotoeléctricas?
Los elementos monovalentes se utilizan en la fabricación de células fotoeléctricas debido a su capacidad de generar electricidad cuando son expuestos a la luz. En el caso del rubidio y el cesio, se utilizan para fabricar células fotoeléctricas de alta eficiencia y precisión.
Deja una respuesta