Descubre cómo leer los números cuánticos de forma sencilla
Si estás interesado en la física cuántica, es probable que hayas oído hablar de los números cuánticos. Estos números son esenciales para entender la estructura de los átomos y las moléculas, y su interpretación es fundamental para la comprensión de la química y la física cuántica. En este artículo, te explicaremos cómo leer los números cuánticos de forma sencilla, para que puedas entender mejor cómo funcionan los átomos y las moléculas.
¿Qué son los números cuánticos?
Antes de entrar en detalles sobre cómo leer los números cuánticos, es importante entender qué son. Los números cuánticos son valores numéricos que describen las propiedades de los electrones en un átomo. Estos valores se obtienen a partir de las soluciones de la ecuación de Schrödinger, la cual describe el comportamiento de los electrones en el átomo.
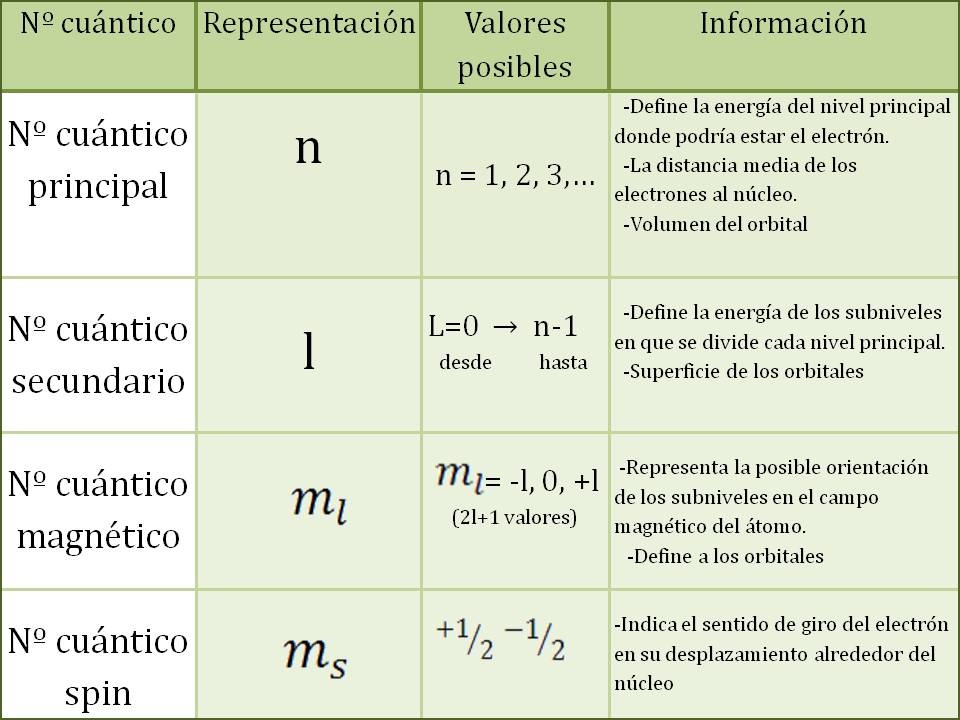
Existen cuatro números cuánticos principales: el número cuántico principal (n), el número cuántico del momento angular (l), el número cuántico magnético (m) y el número cuántico de espín (s). Cada uno de estos números tiene un rango de valores permitidos, que se describen en detalle a continuación.
Cómo leer el número cuántico principal (n)
El número cuántico principal (n) describe el nivel de energía en el que se encuentra un electrón en un átomo. Este número puede tomar cualquier valor entero positivo, desde 1 hasta infinito. Cuanto mayor sea el valor de n, mayor será la energía del electrón y mayor será su distancia media respecto al núcleo del átomo.
En otras palabras, el número cuántico principal determina el tamaño y la energía de la órbita del electrón. Por ejemplo, si un electrón se encuentra en el nivel n = 1, está en la órbita más cercana al núcleo y tiene la menor energía posible. Si el electrón está en el nivel n = 2, su órbita es más grande y tiene más energía que si estuviera en el nivel n = 1.
Cómo leer el número cuántico del momento angular (l)
El número cuántico del momento angular (l) describe la forma de la órbita del electrón en un átomo. Este número puede tomar cualquier valor entero positivo menor que n. Por ejemplo, si n = 3, l puede ser 0, 1 o 2.
El valor de l determina la forma de la órbita del electrón. Cuando l = 0, la órbita tiene forma esférica. Cuando l = 1, la órbita tiene forma de elipsoide y se llama orbital p. Cuando l = 2, la forma de la órbita es aún más compleja, y se llama orbital d.
Cómo leer el número cuántico magnético (m)
El número cuántico magnético (m) describe la orientación del momento angular del electrón en el espacio. Este número puede tomar cualquier valor entero entre -l y +l.
Por ejemplo, si l = 2, m puede ser -2, -1, 0, 1 o 2. Cada uno de estos valores representa una orientación diferente del momento angular del electrón en el espacio.
Cómo leer el número cuántico de espín (s)
El número cuántico de espín (s) describe la dirección del espín del electrón. Este número puede tomar solo dos valores: +1/2 o -1/2.
El espín es una propiedad cuántica de los electrones que se comporta como un pequeño imán. El valor de s determina la dirección del magnetismo del electrón. Si s = +1/2, el imán apunta hacia arriba, y si s = -1/2, apunta hacia abajo.
Conclusión
Los números cuánticos son esenciales para entender la estructura de los átomos y las moléculas. Aunque pueden parecer complicados al principio, una vez que se entiende cómo leerlos, se puede comprender mejor cómo funcionan los electrones en un átomo. Recordemos que existen cuatro números cuánticos principales: el número cuántico principal (n), el número cuántico del momento angular (l), el número cuántico magnético (m) y el número cuántico de espín (s).
Preguntas frecuentes
¿Por qué son importantes los números cuánticos?
Los números cuánticos son importantes porque describen las propiedades de los electrones en un átomo, lo que a su vez determina cómo se combinan los átomos para formar moléculas.
¿Qué es el número cuántico principal?
El número cuántico principal (n) describe el nivel de energía en el que se encuentra un electrón en un átomo.
¿Qué es el número cuántico del momento angular?
El número cuántico del momento angular (l) describe la forma de la órbita del electrón en un átomo.
¿Qué es el número cuántico magnético?
El número cuántico magnético (m) describe la orientación del momento angular del electrón en el espacio.
¿Qué es el número cuántico de espín?
El número cuántico de espín (s) describe la dirección del espín del electrón.
Deja una respuesta